Регистрация лекарственных препаратов по процедуре ЕАЭС
Евразийский экономический союз (ЕАЭС) – единое экономическое пространство, объединяющее Россию, Беларусь, Казахстан, Армению и Кыргызстан. В ходе работы по упрощению взаимодействия и увеличению товарооборота между странами были разработаны единые процедуры во многих отраслях экономика. В частности были приняты Решения СЕЭК №78 и №88 от 3 ноября 2016 г. о том, что с 2021 года все страны-участницы ЕАЭС обязаны проводить регистрацию лекарственных средств (ЛС) по единым правилам. После этого они вносятся в Единый реестр медицинских средств. Следование единым правилам повышает доступность препаратов в этих странах, а значит улучшает качество жизни населения ЕАЭС.
Регистрация лекарственных препаратов
Чтобы зарегистрировать медицинский препарат по правилам ЕАЭС, и он был внесен в официальный реестр, производитель должен пройти все этапы регистрации.
Регистрация может проводиться либо последовательно в нескольких странах (процедура взаимного признания) или одновременно в нескольких странах (децентрализованная процедура).
Заявитель самостоятельно выбирает референтное государство и процедуру регистрации.
Регистрация по процедуре взаимного признания (Последовательная процедура)
Сначала препарат регистрируется в референтном государстве (обращение возможно только в этом государстве), и только после этого препарат может быть зарегистрирован в других странах посредством процедуры взаимного признания.
Регистрация по децентрализованной процедуре (Параллельная процедура)
Препарат регистрируется одновременно в нескольких странах с выбором референтного государства.
Этапы регистрации
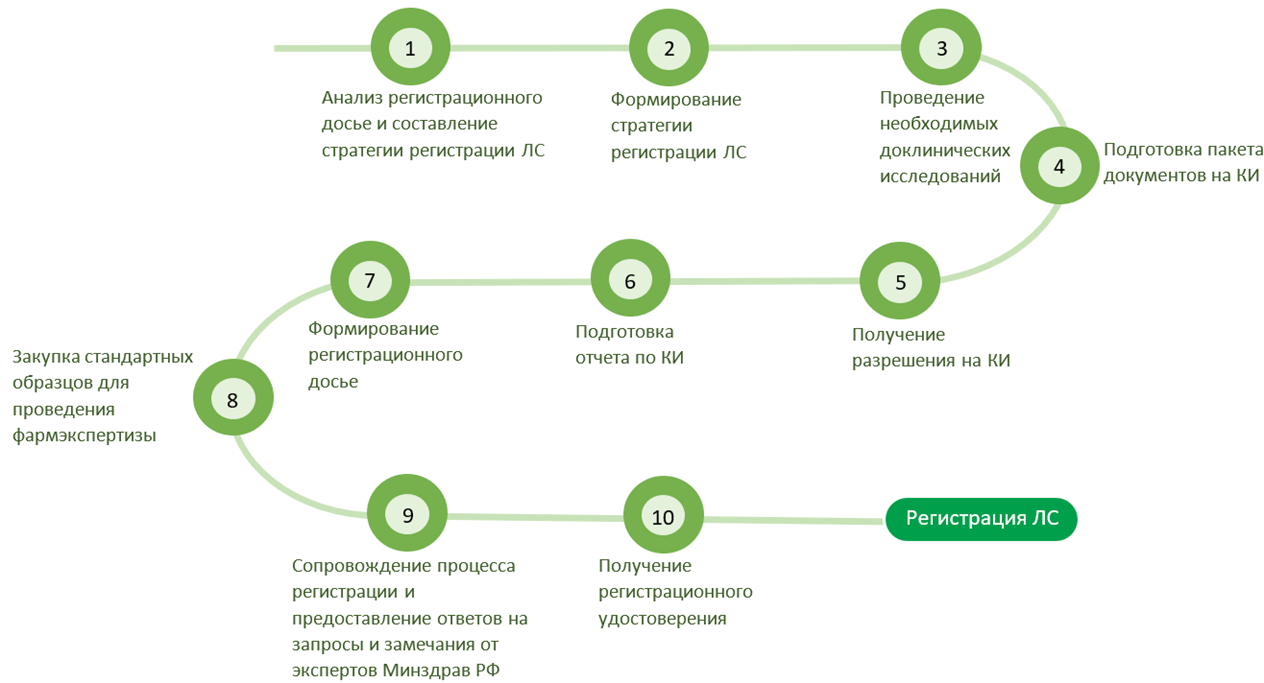
По окончании процедуры производитель получает регистрационное удостоверение (РУ) на ЛС Евразийского экономического союза действительное во всех странах ЕАЭС.
При первичной регистрации РУ выдается на 5 лет. В дальнейшем при проведении процедуры подтверждения регистрации выдается бессрочное РУ (в некоторых случаях при подтверждении РУ может быть выдано повторно на 5 лет).
Сроки *:
- подготовка и подача регистрационного досье – от 30 календарных дней;
- подготовка ответа на запрос МЗ РФ – от 14 календарных дней;
- регистрация и экспертиза лекарственного препарата в случае децентрализованной процедуры – 210 календарных дней;
- регистрация и экспертиза лекарственного препарата в случае процедуры взаимного признания – 210 календарных дней (регистрация в референтном государстве), регистрация в государстве признания – 100 календарных дней со дня представления заявления о регистрации лекарственного препарата по день размещения сведений в едином реестре Союза и выдачи регистрационного удостоверения.
- перерегистрация лекарственного препарата - 120 календарных дней со дня представления заявления о перерегистрации.
*без учета стоп-таймов: время от момента запроса дополнительных материалов и данных до ответа на запрос.
Размеры основных государственных пошлин в РФ (по состоянию на июнь 2023 г.):
- за проведение экспертизы лекарственного препарата для медицинского применения при его регистрации (при первичной регистрации) - 325 000 рублей;
- за проведение экспертизы лекарственного препарата с хорошо изученным медицинским применением при его регистрации - 250 000 рублей;
- за подтверждение регистрации лекарственного препарата для медицинского применения - 207 000 рублей;
- за выдачу регистрационного удостоверения лекарственного препарата для медицинского применения - 10 000 рублей.
Агентство ResearchView предлагает полный перечень услуг по подготовке и подаче регистрационного досье, включая подготовку документов и ответы на запросы от экспертов Минздрава РФ:
- Анализ нормативной документации;
- Разработка проекта общей характеристики лекарственного препарата (ОХЛП);
- Разработка проекта листка-вкладыша (ЛВ);
- Организация проведения и подготовка отчета пользовательского тестирования листка-вкладыша (ПТ ЛВ);
- Рекомендации по оценке комплектности и содержания разделов регистрационного досье;
- Подготовка заявления на государственную регистрацию;
- Подготовка электронной версии и форматирование регистрационного досье в xml-формате;
- Валидация подготовленного регистрационного досье в кабинете заявителя, подача комплекта документов в Министерство здравоохранения;
- Консультативная помощь Заказчику при подготовке документов для ответа на запрос уполномоченного органа;
- Комплектация документов и форматирование регистрационного досье в xml-формате в рамках ответа на запрос/-ы;
- Получение решения о направлении на фармацевтическую экспертизу;
- Мониторинг фармацевтической экспертизы;
- Консультативная помощь Заказчику при подготовке документов для ответа на запрос/-ы уполномоченного органа;
- Комплектация документов и создание новой электронной версии регистрационного досье в xml-формате и подача комплекта документов в ответ на запросы уполномоченного органа;
- Мониторинг экспертизы после подачи ответа на запрос/-ы уполномоченного органа;
- Получение утвержденного комплекта документов Министерством здравоохранения вместе с регистрационным удостоверением по окончании экспертизы.
Для регистрации ЛП по процедуре ЕАЭС в России, Беларуси, Казахстане свяжитесь с нами, оставив свои данные в форме обратной связи.
Наши достижения
(за последний год)
-
Проведено более
110 маркетинговых исследований
-
Опрошено более
30000 респондентов в 35 странах мира
-
Более 100
постоянных клиентов
-
Стоимость исследований
от 350 тыс. до 15 млн. руб.